脑干胶质瘤是一种中枢神经系统肿瘤,约占颅内肿瘤的1%,最高占儿童所有中枢神经系统肿瘤的20%。脑干肿瘤是一组异质性肿瘤,包括低级别病变和极其恶性的病变,预后差异很大。在所有类型的脑干胶质瘤中,弥漫性胶质瘤极具侵袭性。根据2021 WHO分类,弥漫性胶质瘤根据组织学和分子特征被分为少突胶质细胞瘤、星形胶质瘤、胶质母细胞瘤、弥漫性中线胶质瘤。弥漫性中线胶质瘤是一种具有广泛侵袭性的恶性肿瘤,好发于儿童,儿童弥漫性中线胶质瘤生长于神经系统的中线结构,其常见的部位包括丘脑,脑干和脊髓,由于肿瘤呈弥漫性生长、无法完全切除,对放疗和化疗抵抗,预后极差。如果对中线胶质瘤进行活检,H3K27M突变可作为一个重要的诊断指标。尽管使用了不同的放疗(先期常规分割、超分割或低分割放疗)和化疗(放疗前、辅助化疗或放化疗前的新辅助化疗)方案,但总生存期(OS)仅为7.9-12.0个月,不到10%的患者在确诊后存活2年。对于这些用尽各种治疗方法,且处于病情危重,有生命危险的患者而言,有必要采取新的治疗手段。
BNCT是放射与药物相结合的靶向、细胞级精准放疗,已经在脑胶质瘤、恶性黑色素瘤和复发性头颈部肿瘤取得很好疗效。虽然BNCT对周围正常脑组织的损害很小,且增加剂量理论上可以提高疗效,但增加BNCT剂量可能会增加假性进展和放射性脑坏死的风险。此外,终末期患者也难以承受高剂量的治疗后果。
在本研究中,我们报道了一组脑干肿瘤终末期患者接受两次低剂量BNCT的临床结果。本研究的目的是评价BNCT对终末期脑干胶质瘤患者的治疗价值。
患者选择
2017年3月至2021年12月,台北荣民总医院确认了符合紧急和同情使用原则的终末期恶性脑瘤危重患者,并对患者详细介绍BNCT,所有患者或监护人在治疗前均知悉并已签署知情同意书。
治疗过程
本研究治疗方案是在日本京都大学方案的基础上修改而来。由于符合条件的患者病情危重,可能危及生命,本研究采用的治疗策略为两次低剂量BNCT,间隔约1个月。在中子照射前,使用18F-BPA-PET根据SUV均值参数,计算肿瘤与正常组织中的硼浓度比(T/N)和肿瘤与血液中的硼浓度比(T/B)。
患者在BNCT前接受2小时L-BPA(200mg/kg)静脉滴注,然后持续滴注L-BPA(100mg/kg),以保持中子照射期间恒定的血硼浓度。每位患者总输注剂量为500mg/kg。所有患者都接受了两次BNCT,根据肿瘤体积(Gross Tumor Volume)和血硼浓度计算每位患者的治疗剂量。治疗剂量由每个吸收剂量值乘以每个组织的RBE或CBE,并把得出的结果相加来获得光子等效剂量。在本研究中,正常皮肤和脑干肿瘤的10B(n,α)7Li反应CBE值分别为2.5和3.8。热中子和光子的RBE值分别为3.2和1.0。
BNCT后,所有患者均入住台北荣民总医院神经外科病房,并给予5mg处方类固醇,以避免神经功能恶化,如放射性坏死。此外,所有患者在BNCT后,每两周接受5-10mg/kg剂量的贝伐珠单抗,以避免放射性坏死的发展。所有患者在BNCT 4周后行MRI检查,以评估首次治疗反应,每3个月进行一次定期随访。
疗效评估
在BNCT治疗前后分别行MRI扫描,根据神经肿瘤学反应评估标准(RANO)评估患者放射学反应。CR定义为治疗后脑干肿瘤完全消失。PR定义为BNCT 后肿瘤病灶(最大横切面面积)减少50%及以上,并维持至少4周。PD定义为BNCT后肿瘤体积增加25%。SD定义为BNCT后肿瘤体积缩小未达PR、CR,或增大未达PD。所有患者每1-3个月随访一次,并进行MRI检查和神经系统检查。BNCT后毒性根据美国国家癌症研究院(NCI)的不良事件评价标准(CTCAE)5.0 版进行评估。复发时间定义为BNCT治疗后到肿瘤复发的时间。
结果
共7例患者接受BNCT同情治疗,男性4例,女性3例(表一)、7例患者中,4例为12岁以下儿童。神经节胶质瘤(Ganglioglioma)1例,低级别胶质瘤伴多形性黄色星形细胞瘤(WHO II级) 1例,胶质母细胞瘤1例。高级别胶质瘤4例,其中1例为星形细胞瘤进展为高级别胶质瘤,2例为弥漫性中线胶质瘤。所有患者接受两次 BNCT(单次剂量:5-10 Gy-E),间隔约1个月。第一次和第二次的肿瘤中位剂量为7.22 Gy-E和6.62 Gy-E。在第一次和第二次中子照射时,血硼浓度中位数为24.83 ppm和26.95 ppm。第一次BNCT的T/N、T/B平均值为3.02、3.41,第二次为2.77、2.76。BNCT照射均在30分钟内完成。经过两次BNCT,部分患者发生了轻度的急性不良事件,如放射性皮炎和脱发,并接受了止痛药和外用类固醇保守治疗。没有患者发生4级急性或晚期不良事件。有1例弥漫性中线胶质瘤患者BNCT后出现放射性坏死,这可能与既往接受大分割放疗相关。经MRI评估,CR1例,PR5例,SD1例。3例T/N值较低(低于中位数)和接受治疗剂量较低(低于中位数)的患者,分别在BNCT后第1、12和13个月复发。
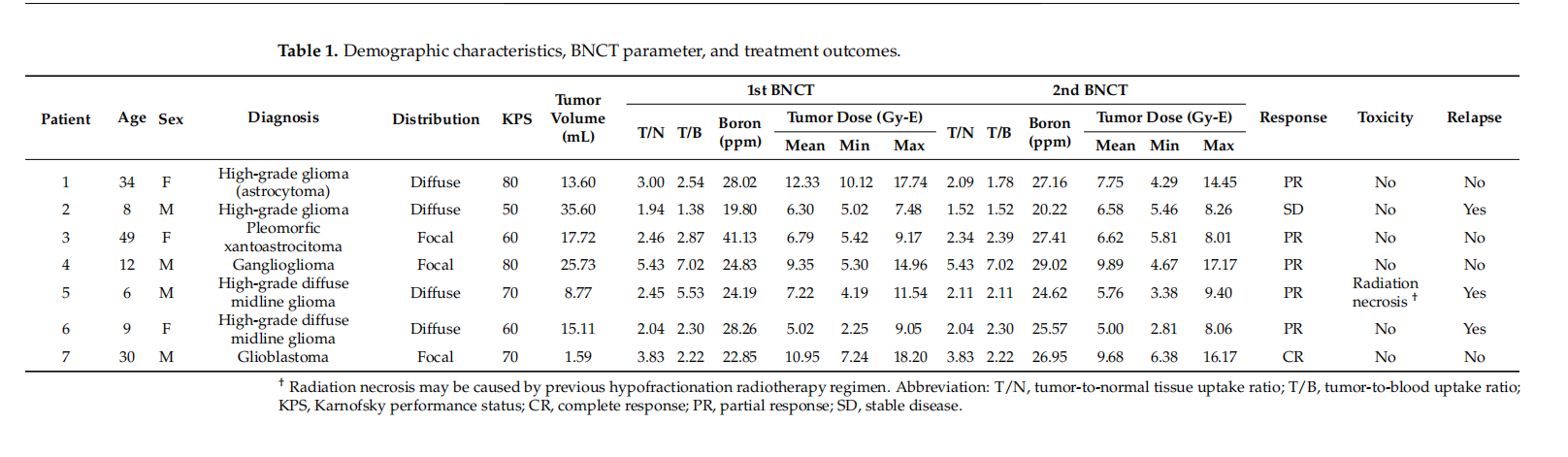
表1:患者特征、BNCT参数、治疗结果
案例1(患者5)
患者为1名6岁男孩,于2020年3月首次出现眼球活动受限并伴有明显的嗜睡。经MRI诊断为弥漫性中线胶质瘤。2020年3月底,他接受常规放疗(39Gy,13次),并于2020年7月接受化疗。后转入台北荣总,经检查,脑部影像显示肿瘤体积为8.77mL,L-BPA摄取研究显示T/N值为2.45(图1A)。患者分别于2020年7月17日和2020年8月14日接受两次BNCT。第一次BNCT治疗的平均肿瘤剂量为7.22Gy-E,最小肿瘤剂量为4.19Gy-E,最大肿瘤剂量为11.54Gy-E。在第一次BNCT时,血液中的硼浓度为24.19ppm。第一次BNCT治疗1个月后,18F-BPA-PET显示,T/N比值下降至2.11(图1B)。第二次BNCT的平均肿瘤剂量为5.76Gy-E(最小剂量3.38Gy-E,最大剂量9.40Gy-E),血硼浓度为24.62ppm。
两次BNCT后,随访显示PR,但肿瘤在桥脑逐渐增大(4.2cm×3.1cm×2.4cm),并伴有明显的周围水肿。BNCT后61天复发。MRI随访显示第四脑室出现放射性坏死(图1C),导致急性梗阻性脑积水。患者的症状仍在进展,包括眼外运动受限(EOM),伴有双侧内斜视、面部表情减退、言语模糊、吞咽困难、左侧偏瘫、轻度排尿困难和便秘。经置入右脑室腹膜分流术,并给予甘露醇和地塞米松以缓解颅内压升高;患者在BNCT后4.9个月死于疾病进展。
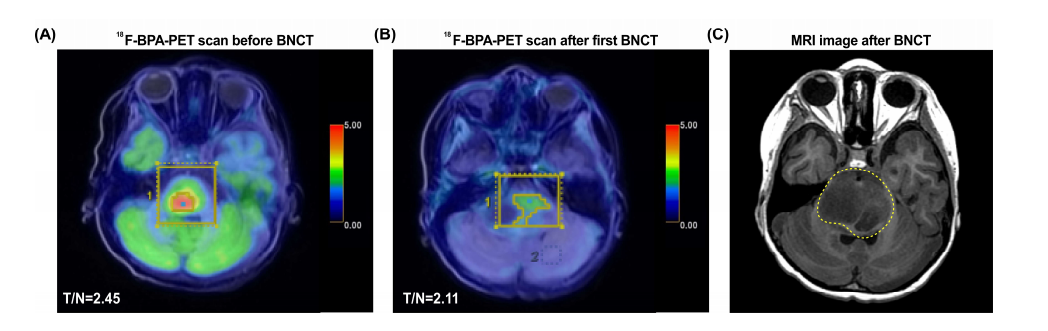
图1:PET和MRI图像
案例2(患者3)
患者为49岁白人女性,2016年诊断为毛细胞型星形细胞瘤(WHO I级)。2018年病理诊断提示间变性,在手术以及多种放化疗方案失败后,2019年转至台北荣总。经检查,该患者脑干上方处肿瘤复发(图2A),并进展为多形性黄色星形细胞瘤(WHO II级),符合紧急和同情使用原则。按计划进行两次BNCT治疗,18F-BPA-PET结果显示,第一次BNCT的T/N和T/B值为2.46和2.87,第二次BNCT的T/N和T/B值为2.34和2.39。第一次BNCT的平均、最小和最大脑肿瘤剂量分别为6.79、5.42和9.16 Gy-E。第二次BNCT的平均、最小和最大脑肿瘤剂量分别为6.62、5.81和8.01 Gy-E。在第1次、第2次BNCT治疗中,血硼浓度分别为41.13 ppm和27.41 ppm。未观察到严重急性或晚期毒性反应。随访显示,患者达到了PR(图2B),至今未复发。在接受两次BNCT后,目前患者存活超过662天。
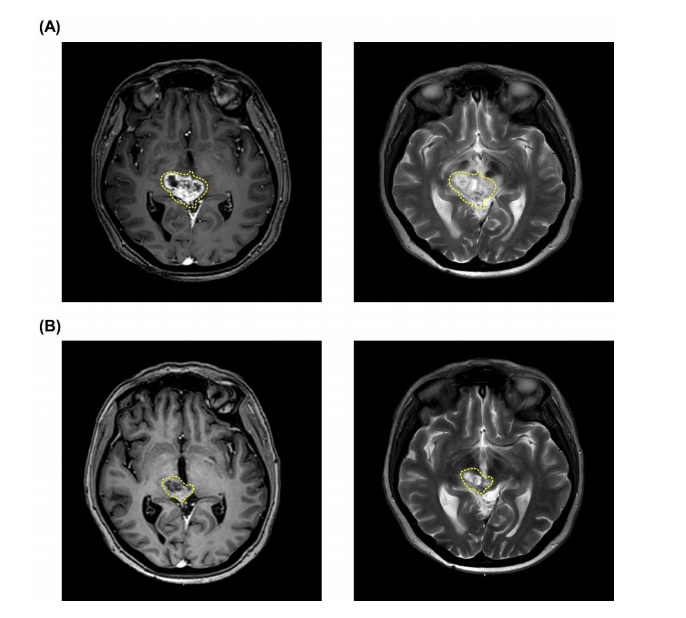
图2:肿瘤缩小的MRI图像,A为BNCT治疗前,B为BNCT治疗后。黄色虚线处代表肿瘤。
案例3(患者7)
该男性患者2019年首次出现头痛和头晕,在30岁时被确诊为间变星形细胞瘤(WHO 3级)。2019年,该患者接受手术和放化疗。随访MRI显示,患者两年后肿瘤复发,活检确诊肿瘤进展为复发性胶质母细胞瘤。由于该患者病情危重,随时可能发生生命危险,且没有其他治疗选择,符合紧急和同情使用原则,因此获得BNCT同情治疗。
18F-BPA-PET检查显示T/N比为3.83。患者在2021年11月、12月共接受两次BNCT治疗。第一次和第二次BNCT的平均肿瘤剂量为10.95 Gy-E和9.68 Gy-E。在第一次和第二次BNCT治疗期间,血硼浓度分别保持在22.85ppm和26.95ppm。患者在两次BNCT治疗后获得了CR(图3),未观察到严重急性或晚期毒性反应。截止到交稿时,患者身体状况良好,没有复发和进展。
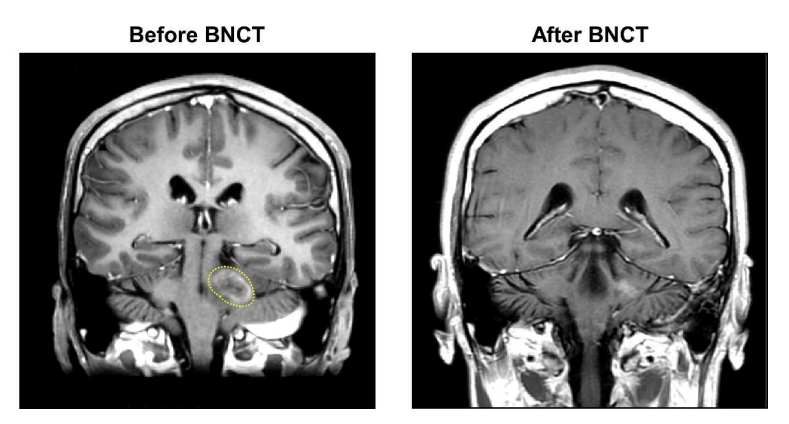
图3:肿瘤缩小的MRI图像,经过两次BNCT,患者达到CR,黄色虚线处表示肿瘤。
在本研究中,BNCT对所有治疗方法都用尽的终末期脑干肿瘤患者显示出治疗希望。无论瘤体体积多大,我们的两次低剂量BNCT治疗方案都可以在一定程度上延长患者生存时间。除了1例患者因既往放疗出现放射性坏死外,没有患者出现严重急性或晚期毒性反应。此外,我们发现BNCT后复发的患者有三个共性特点:年龄较低(<12岁),T/N值较低(低于中位数<2.46),较低的治疗剂量(两次均低于中位数:第一次< 7.22 Gy-E,第二次< 6.62 Gy-E)。
值得注意的是,我们观察到两名长期生存的患者,尽管在BNCT前被诊断为终末期脑干肿瘤并处于危及生命的状态,但BNCT后超过18个月无复发。总体而言,对于终末期脑干肿瘤患者而言,两次低剂量BNCT治疗是有效的,并且没有严重的急性或晚期毒性反应。
脑干胶质瘤是一组高度异质性疾病,是当前最具挑战性的肿瘤类型之一,多次临床试验未能提高生存率。一些研究发现,较高年龄、较低的KPS评分、较高肿瘤分级和出现放射性坏死是影响患者生存和预后的不利因素。然而,在我们的研究中,年龄、KPS和肿瘤分级似乎并没有影响BNCT的疗效。相反,较年轻的患者可能更易复发。在我们的研究中,3例儿童患者(患者2、5、6)在两次BNCT后均复发。这3例儿童患者T/N值较低,肿瘤吸收的硼较少。从理论来说,肿瘤吸收硼的剂量不足,便难以俘获足够的中子释放杀癌的重离子射线,导致不能完全破坏癌细胞。另一方面,为了避免严重不良事件和保证生存质量,我们对这些儿童患者实施了剂量分割策略。低T/N比值和低治疗剂量可能是这些儿童肿瘤复发的主要原因。我们建议,在低剂量策略下增加BNCT的分割次数,以提高BNCT对儿童脑干肿瘤的治疗效果。
脑干胶质瘤是危害性非常大的恶性脑瘤之一。通过BNCT,我们可以尽可能地延长生命,同时极大地改善患者生存质量。我们采取两次低剂量BNCT治疗方案,第一次可以针对较浅的肿瘤部分,第二次可以针对较深的残余肿瘤。此方案可以有效减少不良事件的发生,并且两次BNCT可以提供足够的肿瘤治疗剂量,同时使得单次剂量保持在耐受范围内。
结论
对于终末期脑干胶质瘤患者而言,基于低剂量分割策略的BNCT是一种安全有效的治疗手段。
对于儿童脑干肿瘤患者而言,由于其T/N值较低,当T/N值无法提高时,未来应考虑更多的低剂量分割BNCT。
原文链接:
https://www.mdpi.com/2075-1729/12/4/566
免责声明:本网站专注介绍全球BNCT科研及临床进展。本文仅作信息交流之目的,文中观点不代表中硼医疗的立场,亦不代表中硼医疗支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。